过去十年中,类器官的发展被誉为是干细胞研究中最令人振奋的进展之一。早在 20 世纪 80 年代,“organoid” 一词就已经提出,但直到 2009 年, 2009 年,荷兰科学家 Hans Clevers 团队成功将 Lgr5 + 肠道干细胞在体外培养成具有隐窝状和绒毛状上皮区域的三维结构,也就是小肠类器官(small-intestinal organoids),使得类器官的研究翻开了快速发展的新篇章[1]。
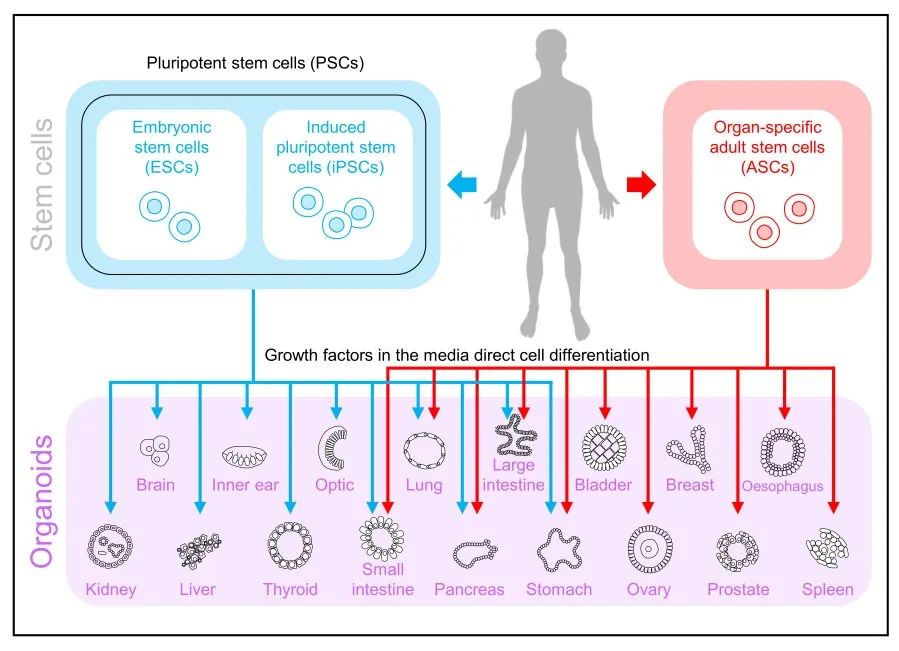
2013 年,类器官被 Science 评为年度十大技术。2018 年初,类器官被 Nature Method 评为 2017 年度最佳方法。目前,多种脏器类器官已被成功构建,其中包括小肠、胃、结肠、肺、膀胱、大脑、肝脏、胰腺、肾脏、卵巢、食道、心脏等,不仅包括正常器官组织类器官,还有相应肿瘤组织类器官。
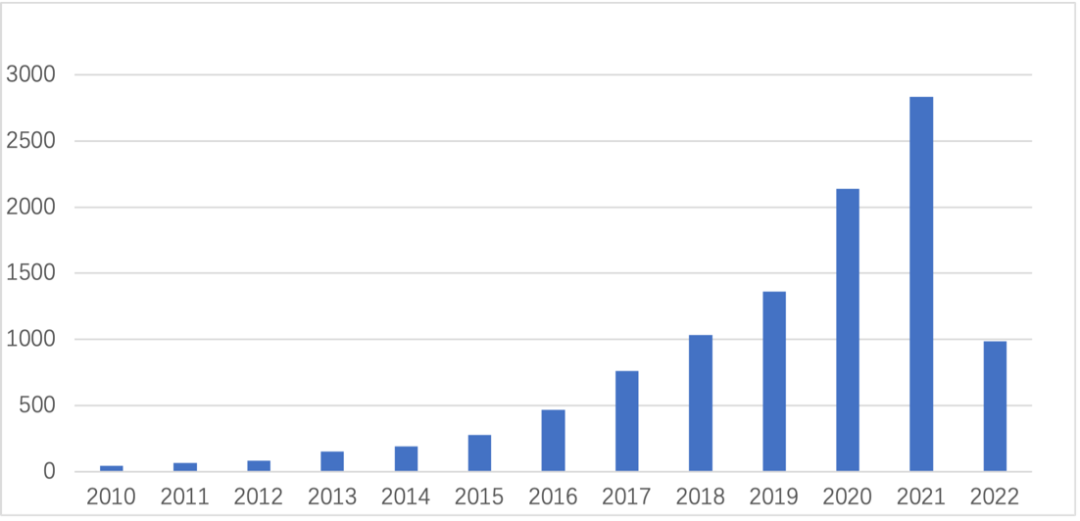
近几年,从 PubMed 公开发表文献中搜索 “Organoids”,涉及类器官技术的文献数量呈现直线上升,其中不乏多篇 CNS 等各大顶级期刊文献。中国发表的类器官文献数量在全球的排名从第六位(2009-2019 年)跃至第二位(2020 年),仅次于美国。中国科研积累的提升将加速类器官产业化的进程。
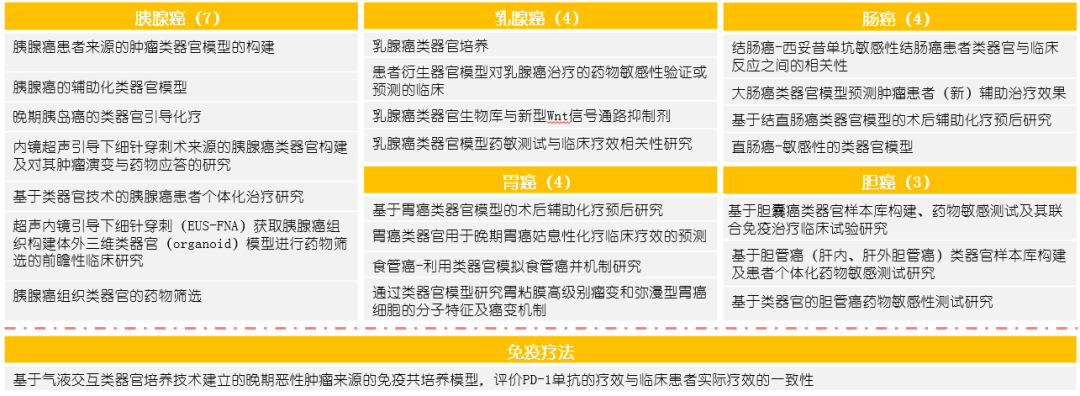
将类器官技术应用于临床,指导临床用药和精准治疗是近期类器官技术的主要发展方向。事实上,自 2016 年起,类器官技术已被纳入临床试验中,截止到 2020 年 9 月,已有 63 起临床试验于 FDA 官方备案。中国国内 2017 年起注册且获伦理委员会批准的类器官临床试验研究有 20 项,涵盖 8 个癌种。主要关注化疗方法的疗效预测,但已有研究开始关注免疫疗法在类器官中的应用(长海医院,pd-1)。从癌种分布看,目前国内研究癌种多为消化系统肿瘤、胰腺肿瘤、乳腺肿瘤。
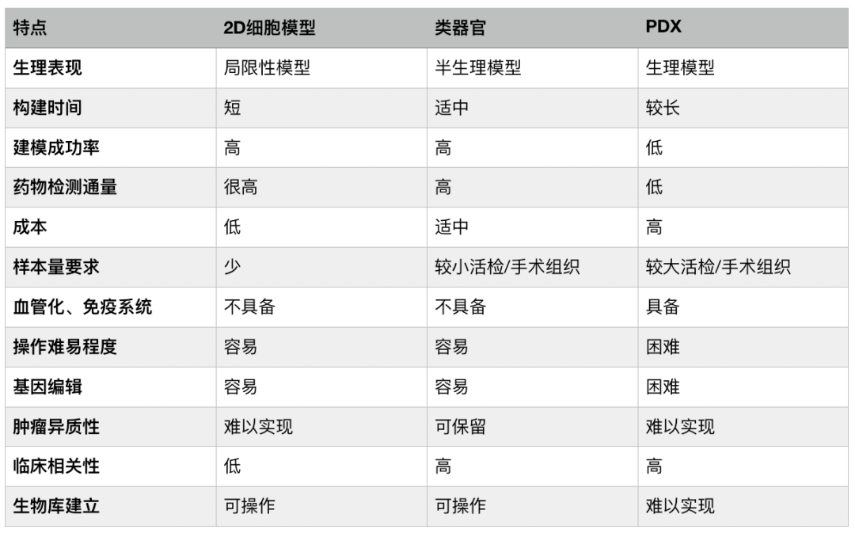
人源性动物移植模型(PDX),是将肿瘤组织移植到免疫缺陷小鼠体内的肿瘤模型。主要问题有移植的成功率较低、构建成本高、周期长,对于药物筛选的通量有很大局限性等。另外,免疫缺陷小鼠体内肿瘤微环境和人体有一定差距,移植的肿瘤组织还可能发生小鼠样进化。
肿瘤临床上可以推广的药筛模型必须能够满足三大基本要求包括需要在短时间内出具药敏检测结果、药物筛查通量高、预测效果准确,而类器官在这三方面对比其他药筛方法都显现出了强劲优势。
1. 速度快
类器官构建成功率高以及培养速度快。常规来说,在类器官培养一周之后就可以进行药筛。从样本采集到出具药敏结果的全流程已经可以很好地控制在 2 周之内[4]。
2. 通量高
从可筛查的药物通量来说,利用类器官不仅可以在孔板上进行多种药物的筛查,每个药物还可以测试不同的浓度,多个实验平行开展。
3. 临床相关性强
类器官用于癌症药筛的临床相关性和预测有效性在多篇研究中都已经得到了较为充分的证实。Vlachogiannis G 团队在 Science 发表了肿瘤类器官体外药敏测试指导临床用药的里程碑式研究,在 71 位转移性胃肠道癌提取了 110 份组织构建了类器官,共测试了 55 种抗癌药物。研究结果显示,类器官药筛达到了 93% 的特异性,100% 的灵敏度、88% 的阳性预测率和 100% 的阴性预测率,展现了极高的临床相关性[5]。

类器官的科研应用目前主要集中在疾病模型研究、疗效预测等方向。目前多所高校和医院已经开展了相应的科学研究,如中科院、清华、浙大、北京天坛医院、浙大附一等。PDO 技术路线比起传统路线的优势与潜能已获得学界认可,PUBMED 发布的含 Organoid 的学术论文于 2019 年已经超越 PDX 模型论文年发表数量,中国国内 2017 年注册且或伦理委员会批准的类器官相关临床试验研究达到 20 项。
但未来类器官科研市场将来相对增长放缓,类器官服务方将以销售试剂耗材为主。随着科研市场进一步发展,科研院校将搭建并优化自己的平台做培养和检测,但科研市场高度定制化需求难以提供标准化服务。
临床研究应用目前主要为癌症中晚期患者提供精准治疗。病人直接试药耗时长、风险大且过程痛苦,特别是缺乏有效药物只能通过化疗的肿瘤患者,难以及时找到有效解决方案。而类器官可代替病人试药,实现精准治疗。目前类器官以化疗药的敏感性检测为主,而未来用于靶向药和免疫治疗则具有更大的潜力。
目前包括南方医院、长海医院、华西医院、复旦大学附属肿瘤医院等医院已经开展了相应的临床研究。目前类器官的临床市场仍在培育阶段:由于未写入指南,患者的认知度以及临床医生的送检意愿有限,随着 PDO 在临床应用的增加,预计在精准治疗趋势下, PDO 在临床市场的需求将大幅度增长。类器官对于患者,尤其是对于缺乏有效药物只能通过化疗的肿瘤患者,有极大价值,其可以作为实现精准治疗的有效工具。
类器官在商业市场的应用主要在新药研发以及拓展适应症等方向。目前大约 85% 的临床前药物在进入临床试验后开发失败,造成巨大的花费和损失。而类器官可在临床前进行更充分的效价评估,对于后期药物开发成本的降低有巨大的价值;在抗肿瘤药物研发中, PDO 能够高通量低成本地反应肿瘤异质性,有效弥补 PDX 动物模型的不足;类器官作为 “患者替身” 的 Phase 0“准临床试验”,可提高临床试验成功率。目前国外药企包括罗氏、利来等,国内企业包括先声药业、恒瑞、齐鲁药业以及药明康德等药企与 CRO 也参与进来。
目前类器官药物研发市场仍在初始阶段,药企仍在观望阶段,类器官公司的目前收入主要为验证服务。类器官非新药递交的必选项,药企仍遵循适用性策略,且类器官技术成熟度和样本库存量仍有限,成为决策的主要顾虑。但不可否认的是类器官技术能够极大程度赋能药企做风险管理,并降本增效,药物研发市场将具有最大的商业价值。在 me-too 背景下,药企对于新药研发降本增效、提高成功率的需求剧增,未来对于类器官带来的价值的支付意愿相较于其他市场更强。
2021 年 1 月 28 日,科技部下发的《关于对 “十四五” 国家重点研发计划 6 个重点专项 2021 年度项目申报指南征求意见的通知》中,把 “基于类器官的恶性肿瘤疾病模型” 列为 “十四五” 国家重点研发计划中首批启动重点专项任务。
2021 年 11 月 30 日,国家药监局药审中心发布《基因治疗产品非临床研究与评价技术指导原则(试行)》和《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》(1),首次将类器官列入基因治疗及针对基因修饰细胞治疗产品的指导原则当中。


微流控芯片相较于传统动物实验,拥有三个技术优势:
(2)更好模拟体内环境和反应:能够控制细胞和特定组织结构,且具备组织血管化及灌注能力;
(3)便于监测健康状态与动态:纳入实时组织功能传感器,如微电极或光学显微镜标记物(如荧光生物标记物)。
(1)集成技术难点:科研领域:国内科研领域多用膜,但加工成本很高,很多学校的科研机构在做膜的集成,但做得不好;商业领域:多数在培养皿 / 类培养皿结构上借助水流和压力完成,用膜结构的技术难度大于膜的集成和膜的加工技术,培养皿作为成套系统,集成较难。
(2)重复性较低:给药浓度的调控,最后样品的收集,不是每次实验都能重复得很好。性价比不高。
(3)硬件壁垒:与国外差距主要在于光刻机的精度、耐久性。

当前 Biobank 的难点在于:
1. 样本库里组织有限,类器官模型目前的数量以及涵盖的癌肿远不及 pdx :
1a. 主要存储的为主流癌肿:肺癌、肠癌、胃癌、乳腺癌,另外较多的还有胰腺癌和头颈癌。
1b. 由于类器官公司主要通过提供药敏检测获取样本,正常组织类器官存储量很有限
2. 类器官模型培养及维持的成本高,技术也有不足. 类器官的复苏与扩增的失败率较高,冻存稳定性需要继续挖掘。
中国在类器官领域中,近年来呈现出科研数量大幅度上升的趋势,尤其在 2019-2020 年这两年间显现出了强劲的发展势头,发表的文献数量在全球的排名从第六位(2009-2019 年)跃至第二位(2020 年),仅次于美国。
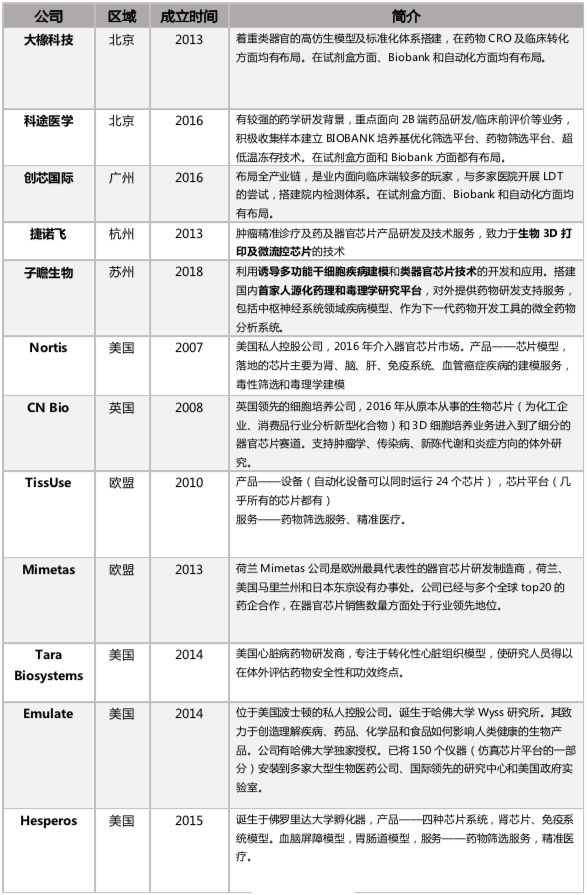
参考表 5 可以发现,国外专注类器官的公司数量较少,不少公司原来的主营方向为干细胞相关的业务,后续才拓展出了类器官板块。由于上述壁垒,国内开展肿瘤药筛的类器官公司数量也并不多,但是融资成功的公司(如科途、创芯等)都具备自主研发创新类器官耗材的能力,在类器官培养的各个环节中都掌握着自己特有的 know-how,在产业化方面的进展对比国外并没有明显的落后趋势。

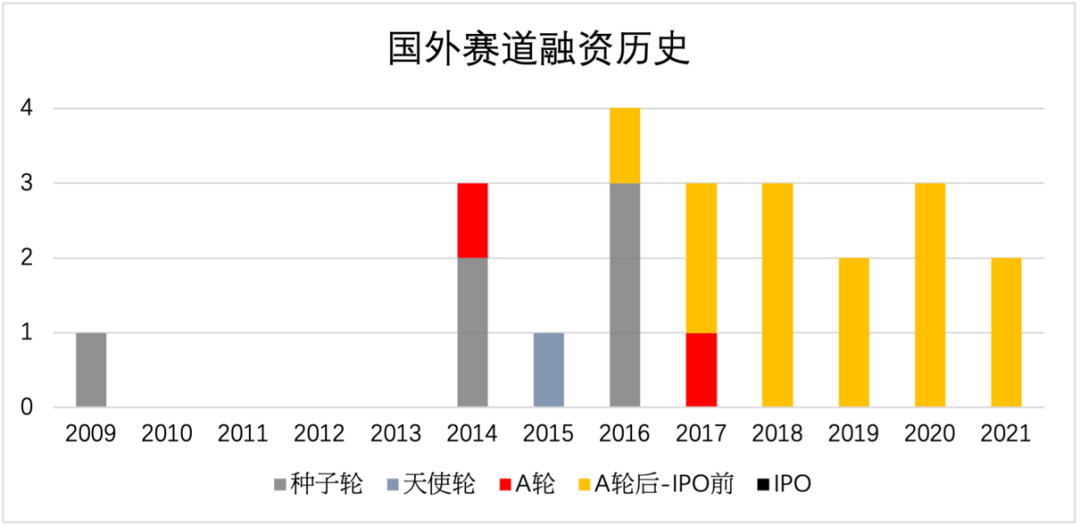
从投融资次数和金额来看,类器官整个行业都还处于比较早期的阶段,类器官行业尚未在国内形成集中化产业集群。竞争刚刚起步,拥有核心技术优势和完整生产链、尽早布局该行业的企业将具有先发优势。
另一发展契机在于,目前国内外行业都还没有建立完善标准,因此中国类器官公司以及研究机构在类器官技术的标准化以及应用指南的建立等方面可以积极参与,未来在行业中可掌握主导优势和话语权[11]。
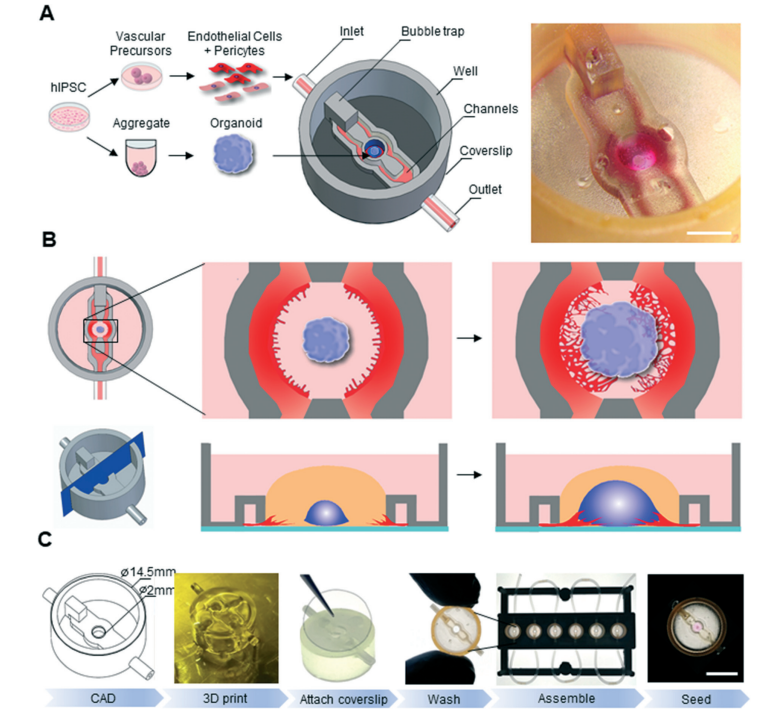
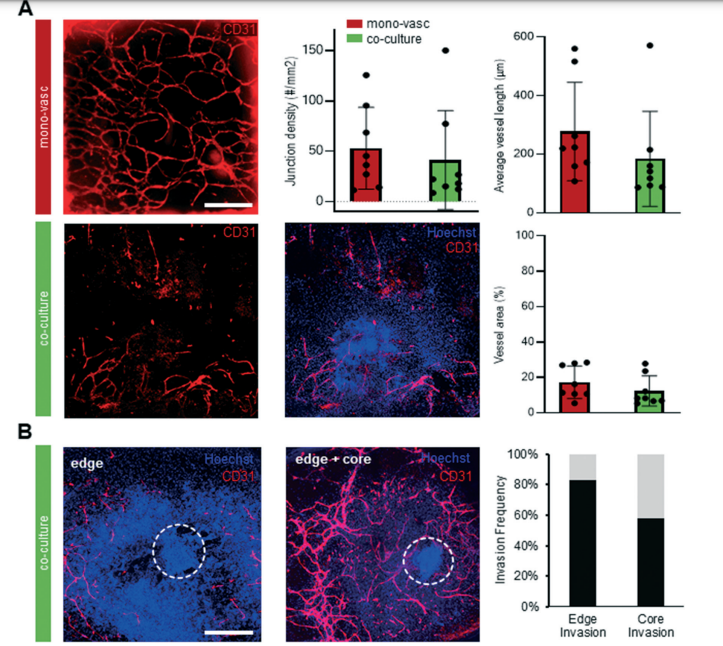
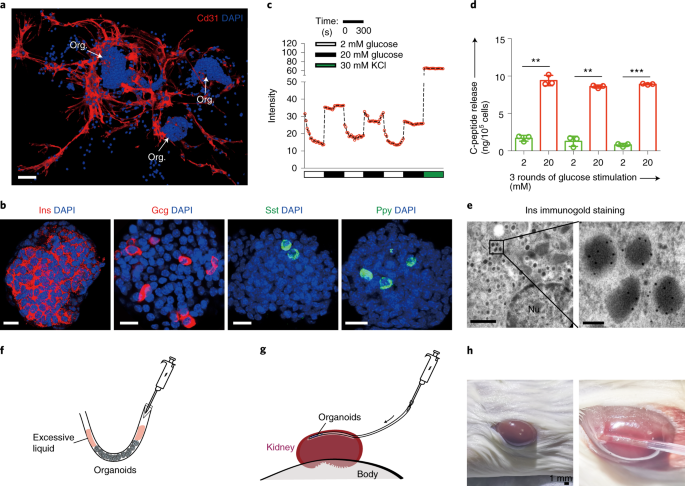
2. 体外β细胞类器官有望为胰岛再生提供新方案
2. 免疫化。血管化以外的难点还包括模拟肿瘤和免疫环境的相互作用关系。2019 年 Nature Protocol 发表了肿瘤类器官和免疫细胞共同培养的相关 protocol,可以体现和模拟出肿瘤微环境的部分特征[6]。以上皮类器官和免疫细胞共培养模型为例,可通过在培养基中添加活化的免疫细胞、在组织消化成单细胞后和免疫细胞共同生长、添加 ECM 中的重组细胞因子等方法重塑类器官和免疫细胞的相互作用。
3. 系统化。相比于单个类器官,类器官系统的构建能够对药物疗效和潜在毒性做出更完整全面的评估。目前类器官仅能检测出药物对于肿瘤的抑制效果,对于其他器官组织是否存在其他副作用和安全性风险并不能做出预判。为了解决这一问题,2017 年 Skardal et al. 构建了有心脏、肺部、肝脏组成的集成于闭合循环关注体中的类器官系统,以达到全面揭示药物对不同器官的毒性和药效的目的[7]。
以血管化来说,类器官在培养至 2 个月左右,如果缺乏营养供给,会和体内器官形成较大差异,但是对于药筛来说只要类器官在合适的环境中生长至细胞小球即可用于药筛。
又比如说,如果某个药物的研究重点是需要跨越血脑屏障,那么脑类器官构建重点便是需要有完整的血脑屏障结构,对于其他特征(如细胞和周围血管的相互作用)可能并不会优先考虑。
血管化、免疫共培养以及系统化的实现可以进一步提高类器官临床预测的准确性,但考虑到周期、成本等关键应用因素,尚且无法兼顾所有条件。有朝一日,如果这些特征都能在成本周期可控的情况下实现,类器官药筛将能够提供更加准确的答案。
制图 | 李乐宁
编辑 | 黄子恩
References:
- Sato, T., Vries, R. G., Snippert, H. J., van de Wetering, M., Barker, N., Stange, D. E., van Es, J. H., Abo, A., Kujala, P., Peters, P. J., & Clevers, H. (2009). Single LGR5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 459(7244), 262–265. https://doi.org/10.1038/nature07935
- Regnard, G., & Hamers, S. (2020, May 28). Organoids: Definition, culturing methods, and clinical applications. CytoSMART. Retrieved May 7, 2022, from https://cytosmart.com/resources/organoids
- World Health Organization. (2020, January 1). Cancer China 2020 country profile. World Health Organization. Retrieved April 18, 2022, from https://www.who.int/publications/m/item/cancer-chn-2020
- Li, M., & Izpisua Belmonte, J. C. (2019). Organoids — preclinical models of human disease. New England Journal of Medicine, 380(6), 569–579. https://doi.org/10.1056/nejmra1806175
- Vlachogiannis, G., Hedayat, S., Vatsiou, A., Jamin, Y., Fernández-Mateos, J., Khan, K., Lampis, A., Eason, K., Huntingford, I., Burke, R., Rata, M., Koh, D.-M., Tunariu, N., Collins, D., Hulkki-Wilson, S., Ragulan, C., Spiteri, I., Moorcraft, S. Y., Chau, I., … Valeri, N. (2018). Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science, 359(6378), 920–926. https://doi.org/10.1126/science.aao2774
- Cattaneo, C. M., Dijkstra, K. K., Fanchi, L. F., Kelderman, S., Kaing, S., van Rooij, N., van den Brink, S., Schumacher, T. N., & Voest, E. E. (2019, December 18). Tumor organoid–T-cell coculture systems. Nature News. Retrieved April 19, 2022, from https://www.nature.com/articles/s41596-019-0232-9/
- Skardal, A., Murphy, S. V., Devarasetty, M., Mead, I., Kang, H.-W., Seol, Y.-J., Shrike Zhang, Y., Shin, S.-R., Zhao, L., Aleman, J., Hall, A. R., Shupe, T. D., Kleensang, A., Dokmeci, M. R., Jin Lee, S., Jackson, J. D., Yoo, J. J., Hartung, T., Khademhosseini, A., … Atala, A. (2017). Multi-tissue interactions in an integrated three-tissue organ-on-a-chip platform. Scientific Reports, 7(1). https://doi.org/10.1038/s41598-017-08879-x
- Salmon, I., Grebenyuk, S., Abdel Fattah, A. R., Rustandi, G., Pilkington, T., Verfaillie, C., & Ranga, A. (2022). Engineering neurovascular organoids with 3D printed microfluidic chips. Lab on a Chip, 22(8), 1615–1629. https://doi.org/10.1039/d1lc00535a
- Wang, J., Wang, D., Chen, X., Yuan, S., Bai, L., Liu, C., & Zeng, Y. A. (2022). Isolation of mouse pancreatic islet procr+ progenitors and long-term expansion of islet organoids in vitro. Nature Protocols. https://doi.org/10.1038/s41596-022-00683-w
- Villa, C. E., Cheroni, C., Dotter, C. P., López-Tóbon, A., Oliveira, B., Sacco, R., Yahya, A. Ç., Morandell, J., Gabriele, M., Tavakoli, M. R., Lyudchik, J., Sommer, C., Gabitto, M., Danzl, J. G., Testa, G., & Novarino, G. (2022). CHD8 haploinsufficiency links autism to transient alterations in excitatory and inhibitory trajectories. Cell Reports, 39(1), 110615. https://doi.org/10.1016/j.celrep.2022.110615
- 干细胞者说. (2021, April 14). 肿瘤类器官:替身试药,未来可期. 中国医疗. Retrieved April 19, 2022, from //med.china.com.cn/content/pid/251936/tid/1026
来自:
更多阅读:

