刚过去一个谣言,让某药直接脱销,谣言的主角新冠病毒XBB毒株就已悄然登录。那么XBB到底哪里厉害,为何能够在短时间内成为国际主要流行毒株?
近期,美国哥伦比亚大学何大一、Lihong Liu团队在《细胞》杂志发文,解析了新流行毒株XBB、BQ及其亚变体的惊人免疫逃逸能力,论文认为BQ.1、BQ.1.1、XBB和XBB.1是迄今为止最具抗性的新冠病毒变体,对新冠疫苗和临床单克隆抗体的应用都会造成一定程度的打击[1]。
研究结果显示,疫苗接种者和康复者血清对BQ/XBB及其亚变体的滴度降低了13-155倍,针对原始毒株所开发的单抗已经基本无效。

论文题图
首先我们来了解一下BQ和XBB都是何方神圣。
BQ.1和BQ.1.1是由BA.5演化而来,BQ.1在BA.5的基础上出现了新的K444T和N460K突变,BQ.1.1则进一步拥有了R346T突变。
XBB和XBB.1是两个BA.2谱系变体BA.2.10.1和BA.2.75重组的产物,在BA.2的基础上,XBB出现了S蛋白中的14个新突变,XBB.1还另外具有G252V突变。
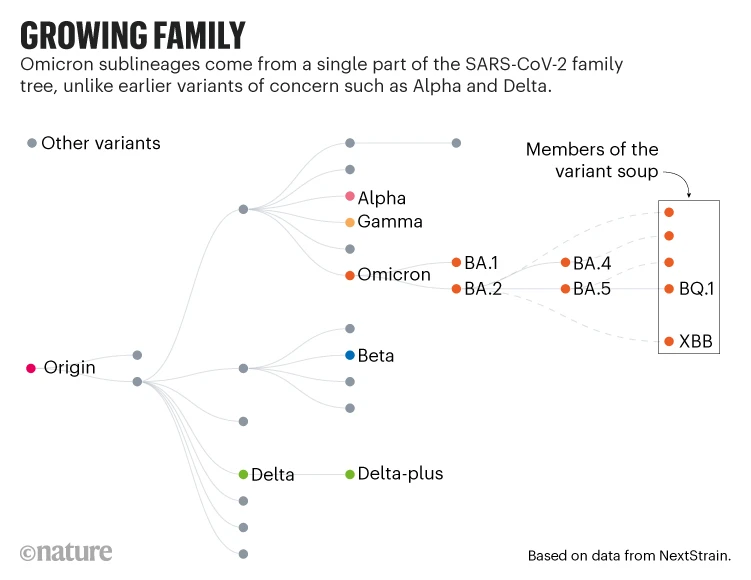
新冠病毒的演化谱系[2]
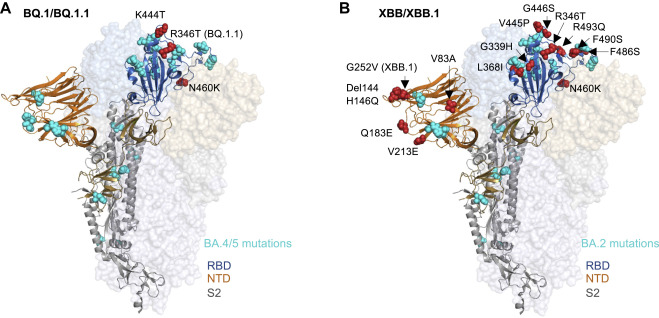
BQ/XBB及其亚变体的主要突变
BQ/XBB及其亚变体自出现以来,速度相当快地成为了主流毒株,这不由得让人想起之前奥密克戎刚刚出现的时候。
那么到底这二位有什么出众之处,又会对当前的防疫手段造成什么冲击呢?
BQ/XBB在短时间内成为主流毒株丨美国CDC[3]
研究测试了血清抗体对BQ.1、BQ.1.1、XBB、XBB.1的中和效果。实验中使用的血清来自五个不同的临床队列,分别来自三针mRNA疫苗接种者、四针mRNA疫苗接种者、三针mRNA疫苗+一针二价疫苗接种者、BA.2突破感染者和BA.4/5突破感染者。
首先我们可以确定BA.2和BA.4/5具有更强的血清抗体中和逃逸能力,相较原始毒株D614G,几何平均ID50滴度分别下降了2.9-7.8倍和3.7-14倍。
令人吃惊的是,BQ.1、BQ.1.1、XBB、XBB.1滴度还要更低,其中XBB.1滴度最低,其次是XBB、BQ.1.1、BQ.1。在三针疫苗血清中,四种变体相对D614G中和滴度分别下降37、55、70、71倍。
另外,突破感染者血清抗体中和滴度明显更高,可以说突破性感染诱导了比接种疫苗更好的抗体反应。
总的来说,BQ.1.1对血清中和的抵抗力比“祖宗”BA.5要强6倍左右,而XBB.1比BA.2要强63倍、比BA.4/5强49倍,可能是奥密克戎所有变体中最“抗揍”的一个。
BQ.1、BQ.1.1、XBB、XBB.1滴度更低
随后,研究测试了临床使用的单克隆抗体对四种变体的中和活性。这些单抗对原始毒株具有明显的活性,包括20种靶向RBD上4类表位的单抗、3种非RBD靶点单抗、1组混合抗体。其中包含已经获得临床授权用于治疗的LY-CoV1404(bebtelovimab)和用于预防的组合Evusheld。
结果并不乐观,从表格的数据可以看出,这些抗体已经近乎完全无效了。
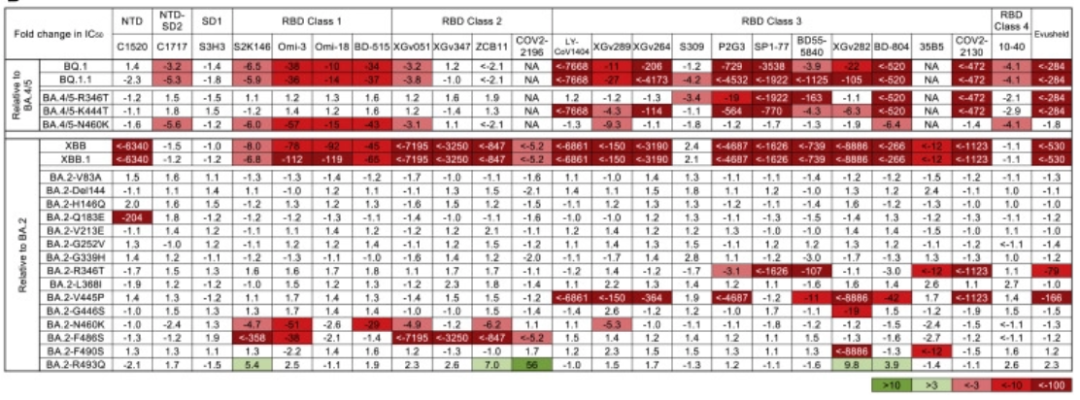
针对多种抗体,BQ.1、BQ.1.1,XBB、XBB.1分别与BA.4/5和BA.2的IC50变化倍数
红色为耐受、绿色为敏感
那么,这是否意味着新毒株会更容易感染呢?
ACE2是新冠病毒进入靶细胞的受体,新冠病毒与ACE2的亲和性会影响到病毒的传播能力。
从实验结果来看,BQ.1和BQ.1.1的S蛋白与hACE2的亲和力与BA.4/5相当,而XBB与XBB.1的S蛋白对hACE2亲和力相对BA.2还略有下降。
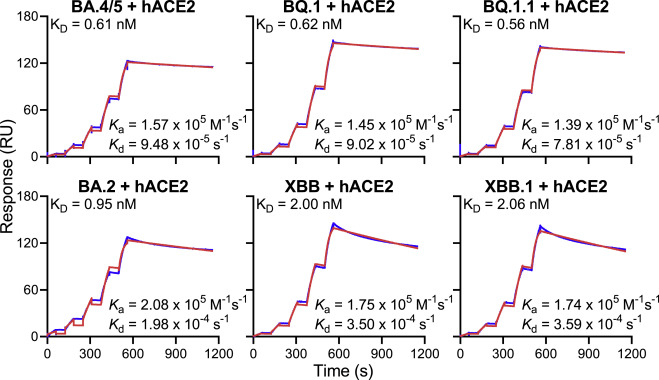
BQ.1、BQ.1.1、XBB、XBB.1与hACE2的亲和力未见升高
从这项研究来看,BQ.1、BQ.1.1、XBB、XBB.1四种新毒株的确具有相当强的抗体逃避能力,但是这并不意味着新毒株会有更强的致病性。
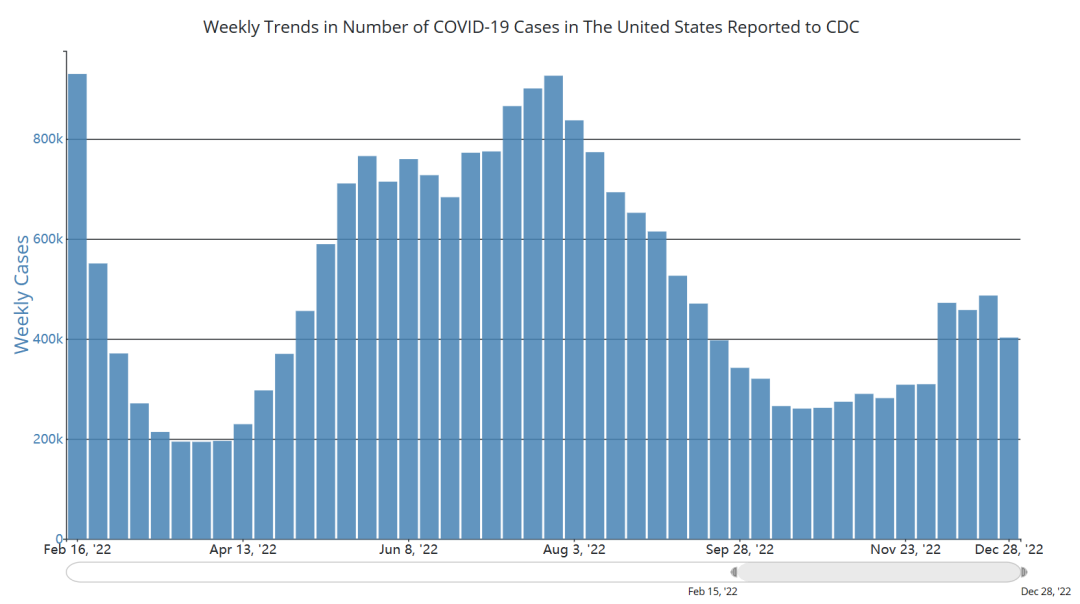
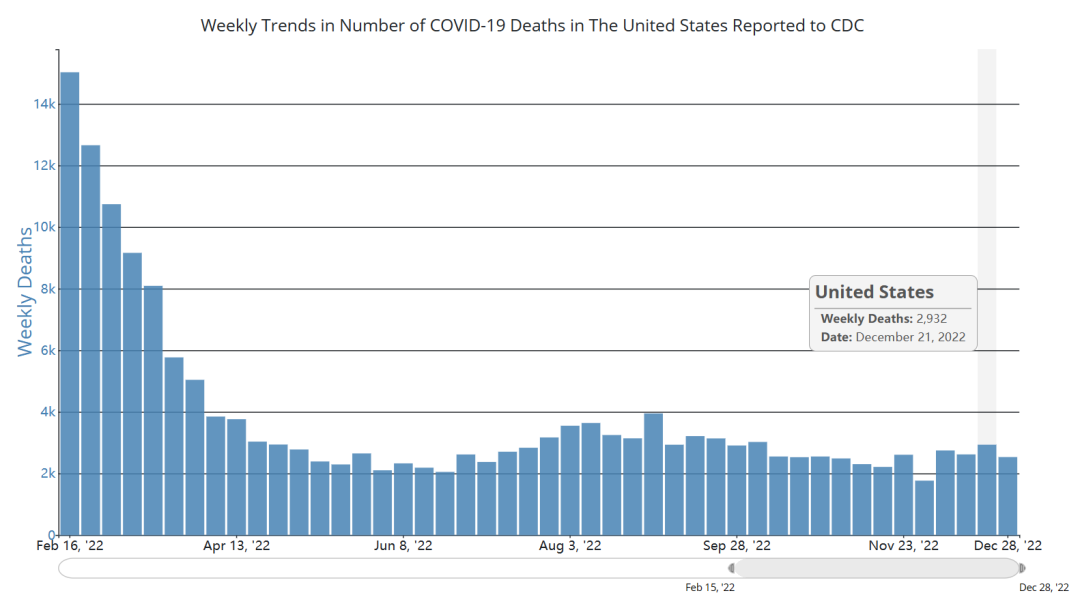
美国CDC公布的数据能够作为有效的参考。虽然在过去一个月内,新毒株、尤其是XBB.1占比快速上涨,但是新增病例数和新增死亡数都未见显著提升,处于全年中的较低水平。

参考资料:
[1]https://www.cell.com/cell/fulltext/S0092-8674(22)01531-8
[2]https://www.nature.com/articles/d41586-022-03533-7
[3]https://covid.cdc.gov/covid-data-tracker/#variant-proportions
[4]https://covid.cdc.gov/covid-data-tracker/#trends_weeklycases_select_00
[5]https://www.biorxiv.org/content/10.1101/2022.12.27.521986v1
[6]https://www.who.int/news/item/27-10-2022-tag-ve-statement-on-omicron-sublineages-bq.1-and-xbb
来自:
更多阅读:
β淀粉样蛋白(Aβ)沉积是AD的典型病理特征,它会引起神经元和突触逐渐丢失,最终引起认知障碍[1]。作为中枢神经系统中专业的吞噬细胞,小胶质细胞在AD的发生发展过程中发挥着重要的作用,Aβ可促进小胶质细胞活化为疾病相关小胶质细胞(DAM)。
TREM2和CLEC7A是小胶质细胞上的免疫受体,它们可以激活下游的脾脏酪氨酸激酶(SYK),促进小胶质细胞活化成为DAM清除Aβ斑块[2,3]。有研究表明,TREM2缺失或者TREM2R47H突变会损害小胶质细胞活化成为DAM的能力,并减弱其清除Aβ斑块的能力[2]。
以上研究表明,SYK有可能在小胶质细胞响应Aβ刺激过程中发挥关键作用,但是目前并没有直接的证据证明这一猜想。近期,由华盛顿大学医学院Marco Colonna教授领衔的研究团队,在顶级学术期刊《细胞》发表研究成果,他们发现SYK确实是小胶质细胞活化成为DAM所必需的,SYK缺失会导致小胶质细胞清除Aβ的能力显著下降,从而加速AD模型小鼠疾病进展[4]。
更重要的是,他们还发现,对于不能激活SYK的TREM2R47H突变型小鼠而言,CLEC7A激活性抗体治疗可以帮助激活SYK,从而增强小胶质细胞清除Aβ斑块的能力。
这项研究成果不仅表明SYK是小胶质细胞响应Aβ刺激的核心调控因子,同时也提示,激活CLEC7A或许是一种有前景的AD免疫疗法。
论文首页截图
为了确定SYK在AD小鼠的小胶质细胞中是否发挥作用,研究团队检测了5xFAD小鼠小胶质细胞中SYK的磷酸化水平,发现相比于WT小鼠,AD小鼠小胶质细胞中SYK总蛋白量并未变化,但是SYK磷酸化水平显著上升。
因此,研究团队构建了小胶质细胞SYK条件性敲除的AD小鼠模型——Syki△MG-5xFAD小鼠,给小鼠饲喂他莫昔芬(TAM)即可诱导小胶质细胞特异性敲除SYK,可以用于研究SYK在AD小鼠小胶质细胞中的功能。
研究团队发现,敲除小胶质细胞上SYK后,在非AD模式小鼠(Syki△MG小鼠)中,小胶质细胞的数量并未发生变化;但是在Syki△MG-5xFAD小鼠(会自发AD)中,敲除小胶质细胞上的SYK后,小鼠大脑皮质和海马区的Aβ沉积显著增加,并且Aβ斑块附近的小胶质细胞数量显著降低,而远离斑块的区域小胶质细胞的密度没有明显变化。体外吞噬功能检测以及体内标记实验均表明,敲除SYK后小胶质细胞吞噬Aβ斑块的能力显著下降。
这些数据表明,SYK对于稳态条件下小胶质细胞的发育和自我更新来说不是必需的,但是SYK对维持小胶质细胞对Aβ的响应能力来说是必需的。
敲除AD小鼠小胶质细胞中SYK损害了小胶质细胞对Aβ的清除能力
既然敲除SYK损害小胶质细胞清除Aβ斑块的能力,那么这是否会影响到AD的进展呢?
为了回答这个问题,研究团队对小鼠大脑进行了免疫荧光染色,结果显示敲除小胶质细胞的SYK后,小鼠大脑中Aβ沉积量明显增加,并伴随着神经元损伤的增加,以及小鼠认知能力的下降。
这些数据表明,敲除小胶质细胞的SYK明显加快了AD的进展。
敲除小胶质细胞中的SYK使Aβ沉积增加,并导致神经元损伤以及认知能力下降
接下来,研究团队通过单细胞转录组测序分析了敲除SYK对小胶质细胞转录组的影响,聚类分析显示,敲除SYK后,DAM细胞几乎消失了,但是增殖状态的小胶质细胞以及DAM前体TM1亚群的数量并未减少。免疫荧光染色也得到了同样的结论。
这些数据表明,敲除SYK后小胶质细胞对Aβ刺激仍有响应,但是并不能完全活化成为DAM。
敲除SYK使得小胶质细胞不能活化成为DAM
之前的研究表明,SYK是TREM2信号通路的关键组成部分,同时也是其他受体下游信号组成部分,因此研究团队想知道SYK缺失和TREM2缺失对小胶质细胞的影响有什么不同。
为了探究这个问题,研究团队整合了SYK缺失小胶质细胞以及TREM2缺失小胶质细胞的单细胞转录组测序数据,分析发现TREM2和SYK缺失后,小胶质细胞均不能获得DAM表型,但是只有SYK缺失的小胶质细胞的DAM前体TM1亚群会增加。
这些数据表明,除了SYK通路之外,TREM2下游应该还有一条其他的通路,这条通路也能支持小胶质细胞增殖和进展到TM1阶段。
通过对TREM2下游接头蛋白的分析,研究团队发现这条信号通路是TREM2-DAP10。值得注意的是,研究人员还发现,TREM2下游的SYK通路和DAP10都是小胶质细胞完全激活所必需的。
SYK与TREM2缺失的小胶质细胞具有不同的分化能力
在之前的研究中,研究人员在人体内发现TREM2R47H突变体不能激活SYK,携带这个突变会使小胶质细胞对Aβ斑块的清除能力下降[2]。因此他们想尝试激活其他能够招募并激活SYK的细胞表面受体,来挽救携带TREM2R47H突变的小胶质细胞。最终选择了CLEC7A——小胶质细胞上的CLEC7A在AD发展过程中上调。
研究团队为TREM2R47H-5xFAD小鼠注射激活性抗CLEC7A抗体后,发现小胶质细胞SYK磷酸化水平升高,吞噬Aβ斑块的能力显著增强。这些数据表明,激活CELC7A能够部分弥补TREM2突变导致的SYK激活不足。
总而言之,这项研究成果表明,SYK对于小胶质细胞完全活化成为DAM来说是必不可少的,SYK缺失会导致小胶质细胞停留在DAM前体状态,清除Aβ的能力下降,加速AD的发展。
机制总结图
对于携带TREM2R47H突变,小胶质细胞中SYK无法激活的情况,该研究提供了一种解决思路——激活CLEC7A,弥补因TREM2缺失引起的SYK激活不足,进而增强小胶质细胞吞噬Aβ斑块的能力。这提示,我们或许可以开发激活CLEC7A的药物来治疗TREM2R47H突变的AD患者。
需要注意的是,在这项研究虽然发现CLEC7A激动性抗体可以激活SYK并增强小胶质细胞的吞噬功能,但是没有研究这种治疗能否减少小鼠大脑中Aβ斑块的数量,以及对小鼠认知的影响。因此,这个研究成果仍待后续研究进一步探索。
来自:
更多阅读:
两个月前,普林斯顿大学赵志磊团队在《自然》发表论文称,与其他动物相比,人类之所以招蚊子喜欢,是因为人类皮脂中存在的癸醛和十一醛能让蚊子兴奋起来[1]。
不过,这个研究只告诉了我们蚊子如何寻找、定位人类,但没有告诉我们为什么有些人类更招蚊子。当然啦,也有一种可能的解释:招蚊子的人类身上散发的癸醛和十一醛“度数”,可能更对蚊子的胃口。
今天,清华大学医学院程功团队在顶级期刊《细胞》上发表的一篇研究论文,让我们对蚊子挑人有了新的认知[2]。
他们发现,一些靠蚊子传播的病毒,在感染宿主之后,竟然能通过调节宿主皮肤抗菌蛋白的表达,影响宿主皮肤微生物群落,导致特定的微生物大量繁殖,释放能吸引蚊子的气味。从数据上来看,蚊媒病毒的这一伎俩,能让围绕宿主的蚊子数量翻倍!
据了解,这是科学家首次发现蚊媒病毒能通过这种方法促进自身在人群中的传播。清华大学医学院博士后张虹和助理研究员朱毅斌,是研究论文的共同第一作者。
论文首页截图
夏天的每一次聚会,我们都会发现蚊子咬人不是随机的,而是有偏好性的。
关于蚊子的这种偏好性,其实已经有很多研究了。
我们也常说,有些人更招蚊子是因为体温高[3],或者呼出的二氧化碳浓度高[4],又或者是身上有特殊的气味[5]。其实这些说法都是有科学依据的。
就在5年前,斯德哥尔摩大学的研究人员发现,疟原虫感染会导致宿主释放更多的二氧化碳、醛类和单萜类物质,让宿主更招蚊子,加速疟疾的传播[6]。
从事蚊媒病毒感染传播机制与抗病毒免疫研究的程功教授注意到,蚊媒病毒是否也能通过类似的机制传播目前仍不清楚。因此程功团队就发起了相关的研究。
研究的思路倒是不复杂。研究人员首先用寨卡病毒(ZIKV)感染小鼠,然后观察伊蚊(Aedes mosquitoes)是更喜欢感染了寨卡病毒的小鼠,还是没感染的小鼠。
统计结果显示,蚊子确实更喜欢感染了寨卡病毒的小鼠:70%的蚊子都被感染小鼠吸引走了,剩下约30%的蚊子去找没感染的小鼠去了。
这真是肉眼可见的密度差异!
把寨卡病毒换成登革病毒(DENV2)之后,结果是一样的。这就说明,蚊子确实更喜欢被蚊媒病毒感染的宿主。
蚊子喜好实验
为了确定究竟是感染后的哪些变化吸引了蚊子,研究人员研究了温度、二氧化碳和气味对实验结果的影响。最后确认确实是气味影响了蚊子的选择。
那究竟是哪种气体呢?
程功团队收集了感染小鼠和健康小鼠身体释放的挥发性气体,经过分析,鉴定出422种化合物,其中有三种(苯乙酮、癸醛和苯乙烯)可以激活蚊虫的嗅觉神经系统,其中反应最强烈的是苯乙酮。
最终,也只有苯乙酮重复了前面70%对30%的实验结果。而且把苯乙酮涂抹到人类的手上,也能吸引更多的蚊子。于是,研究人员就将苯乙酮锁定为吸引蚊子的化学物质。
苯乙酮落网
不过,苯乙酮这种物质毕竟是从小鼠身上分离到的,人类能不能释放这种物质还不清楚。
为了进一步证实人类也能产生苯乙酮,研究人员又招募了一批登革热患者和健康志愿者,并收集了他们胳肢窝的挥发物。
人体采集过程
结果发现,登革热患者释放的苯乙酮比健康志愿者高得多。(实际上,研究人员还在所有参与人员的胳肢窝里发现了癸醛、棕榈酸甲酯和苯乙烯等六种挥发性化合物,但是这六种化合物在感染者组和对照组之间没有差异。这再次说明癸醛可能真不是蚊子更爱咬谁的关键。)
登革热患者释放的苯乙酮比健康志愿者高太多
至此,引诱蚊子的化合物算是找到了,不过,这个物质究竟是哪里来的呢?要知道,哺乳动物的基因组中可不存在合成苯乙酮的酶。这种情况下,矛头只能指向人体微生物了。
于是,研究人员用抗生素鸡尾酒清除小鼠消化道的微生物,用超声刷和70%的酒精去除小鼠皮肤上的微生物。
结果发现,单独清除消化道微生物没用,不影响蚊子对感染小鼠的喜好;而清除了皮肤细菌的感染小鼠对蚊子的吸引力大大降低。相对应的,去除肠道微生物,不影响苯乙酮的产生,清除皮肤微生物之后,感染小鼠释放的苯乙酮与未感染小鼠一致了。
如此看来,蚊媒病毒的感染影响了皮肤微生物,进而决定了蚊子的喜好。后续分析发现,是产生苯乙酮的芽孢杆菌增加了。
就是这四种芽孢杆菌
那病毒感染又是如何影响皮肤芽孢杆菌丰度的呢?研究结果让人吃惊!原来是蚊媒病毒会抑制皮肤产生抗菌蛋白(RELMa),导致能产生苯乙酮的细菌在宿主皮肤上的大量增殖。
到此,这条逻辑链条就清晰了。蚊媒病毒感染宿主之后,抑制皮肤产生抗菌蛋白,导致芽孢杆菌大量增殖,释放大量的苯乙酮,招来蚊子,促进病毒的传播。
行文到此处,我不由得感慨:蚊媒病毒和蚊子之间的这种协同进化真是奇妙。
不过,奇妙归奇妙,如果任由病毒和蚊子合作,人类就要遭殃了。虽然我们已经有蚊帐和灭蚊药,但这还远远不够,如果能打破病毒的这个传播闭环,说不定就有望阻止蚊媒病毒的大范围流行。
好在程功团队也找到了应对之策,他们发现让感染小鼠服用维生素A衍生物——异维甲酸之后,可以促进小鼠皮肤产生抗菌蛋白,抑制产生苯乙酮的细菌增殖。小鼠实验也表明,在感染小鼠的食物中添加异维甲酸之后,蚊子对感染小鼠和未感染小鼠的喜好就变得一样了。
据《自然》杂志报道,程功团队目前正在计划开展用维生素A阻止登革热在人与人之间传播的试验[7]。
预祝程功教授试验成功。
参考文献:
[1].Zhao Z, Zung JL, Hinze A, et al. Mosquito brains encode unique features of human odour to drive host seeking. Nature. 2022;605(7911):706-712. doi:10.1038/s41586-022-04675-4
[2].Zhang et al. A volatile from the skin microbiota of flavivirus-infected hosts promotes mosquito attractiveness. Cell 2022, 185, 2510–2522. https://doi.org/10.1016/j.cell.2022.05.016
[3].Corfas RA, Vosshall LB. The cation channel TRPA1 tunes mosquito thermotaxis to host temperatures. Elife. 2015;4:e11750. Published 2015 Dec 15. doi:10.7554/eLife.11750
[4].Gillies M T. The role of carbon dioxide in host-finding by mosquitoes (Diptera: Culicidae): a review[J]. Bulletin of Entomological Research, 1980, 70(4): 525-532.
[5].Cardé RT. Multi-Cue Integration: How Female Mosquitoes Locate a Human Host. Curr Biol. 2015;25(18):R793-R795. doi:10.1016/j.cub.2015.07.057
[6].Emami SN, Lindberg BG, Hua S, et al. A key malaria metabolite modulates vector blood seeking, feeding, and susceptibility to infection. Science. 2017;355(6329):1076-1080. doi:10.1126/science.aah4563
[7].https://www.nature.com/articles/d41586-022-01764-2
来自:
更多阅读:
众所周知,淋巴结是重要的外周免疫器官,抗原呈递细胞在此处将抗原呈递给T细胞,激活抗原特异性的T细胞免疫反应。然而,在肿瘤转移过程中,原位肿瘤如何突破免疫监视进入淋巴结,淋巴结转移又是否通过某种机制参与调控肿瘤远端转移,一直是癌症转移领域内需要解决的问题[1]。
近日,斯坦福医学院Edgar G. Engleman和Nathan E. Reticker-Flynn领导的研究团队,就以上问题在国际顶尖学术期刊《细胞》发表重要研究成果[2]。
他们发现淋巴转移能力强的癌细胞株能上调MHC-I及PD-L1等干扰素诱导基因(ISGs)的表达,帮助肿瘤细胞逃避NK细胞及T细胞对肿瘤细胞的杀伤,进而成功定植淋巴结;实现淋巴转移的肿瘤细胞会促进调节性T细胞(Treg)分化,为远端转移营造免疫抑制的微环境,进而促进肿瘤远端转移。
本研究为理解肿瘤淋巴结转移的相关机制提供了理论基础,对晚期肿瘤的治疗有一定指导意义。
论文首页截图
接下来我们就一起来看看这个研究是如何展开的。
首先他们将低转移性的黑色素瘤细胞B16-F0(母系低淋巴转移株)接种于小鼠皮下,收集淋巴结中转移的肿瘤细胞,再移植到新的小鼠皮下,循环九代不断收集淋巴结定植的肿瘤细胞再移植,如此得到在非引流淋巴结中定植能力不断增强的300株细胞(高淋巴转移株)。
利用这一模型,他们发现无论是皮下还是淋巴结接种,与母系低淋巴转移株相比,接种高淋巴转移株小鼠肺转移明显增强。这些数据提示,高淋巴转移株接种小鼠肿瘤细胞的远端转移能力增强了。
小鼠黑色素瘤淋巴转移模型构建
那么,高淋巴转移株与母系低淋巴转移株相比存在哪些差异呢?
研究人员对不同代高淋巴转移株进行RNA-seq发现,它们均上调ISGs,下调细胞周期相关基因。进一步对这些细胞的ATAC-seq发现,ISGs的表达调控位点的染色质开放程度更高,这与此前报道的慢性干扰素暴露会诱导ISGs基因的表观遗传重编程相一致[3]。
在高淋巴转移株中敲除ISGs的核心转录因子Stat1后,淋巴转移能力显著下调。以上结果说明ISGs在黑色素瘤淋巴转移发挥重要作用。
高淋巴转移株上调干扰素诱导基因集
接下来,研究人员面临的问题是:一型及二型干扰素会诱导数百个ISGs基因表达,具体哪些ISGs促进了肿瘤细胞从原位转移到淋巴结的呢?
ISGs中PD-L1和MHC-1因对肿瘤免疫应答的重要调控作用,而被Reticker-Flynn团队关注[4]。
他们注意到,在高淋巴转移细胞系中,PD-L1(Cd274)和MHC-I分子(B2m,H-2Kb,H-2Db)高表达,且基因组上它们的表达调控区处于持续的开放状态。
此外,他们还发现第一代的高淋巴转移株即高表达MHC-1分子H2,高表达的MHC-1分子可以帮助肿瘤细胞逃避NK细胞对肿瘤的杀伤;同时高淋巴转移株高表达的PD-L1可以帮助肿瘤细胞抑制T细胞免疫应答,这两方面的免疫逃逸有助于实现黑色素瘤细胞从原位到淋巴结的转移。
高淋巴转移株可逃避NK细胞杀伤
回答了肿瘤细胞如何逃避免疫杀伤,实现从原位到淋巴结的转移后,研究人员试图解答肿瘤细胞淋巴转移如何促进远端转移?
为了回答这个问题,研究人员研究了淋巴结的变化。
他们发现,移植高淋巴转移株的小鼠与低淋巴转移细胞株相比,淋巴结中Treg的比例显著上升;高淋巴转移株诱导初始T细胞分化为Treg的能力增强。
我们都知道,Treg细胞是介导免疫抑制的主要T细胞群,可通过抑制抗肿瘤免疫来参与肿瘤的发生和发展[5]。也就是说,高淋巴转移株在淋巴结中营造了一种免疫抑制的微环境。
那这又是如何发生的呢?
Reticker-Flynn团队很快发现,是TGF-β发挥了重要作用。因为高淋巴转移株培养上清及接种小鼠血清中TGF-β水平上升,而使用TGF-β中和抗体或清除Treg细胞可抑制高淋巴转移株的远端转移。
以上结果说明,肿瘤淋巴结转移通过对免疫细胞,特别是T细胞分化的调控为远端转移提供免疫抑制的环境,进而促进肿瘤细胞向远端的转移。
高淋巴转移株通过TGF-β促进Treg分化诱导远端转移
总的来说,Reticker-Flynn团队的这项研究为淋巴结转移领域的两个核心问题:原位肿瘤如何突破免疫细胞杀伤定植于淋巴结;淋巴结转移的肿瘤细胞是否促进远端转移提供了解释。
具体来说,肿瘤细胞上调MHC-I及PD-L1在内的ISGs,以逃避NK细胞和T细胞的免疫监视,促进从原位到淋巴结的转移;淋巴结定植的肿瘤细胞通过上调TGF-β,促进抗原特异性的Treg的分化,诱导肿瘤特异性的免疫抑制,进而促进肿瘤向远端器官的转移。
研究机制模式图
实际上,之前有临床研究发现,黑色素瘤周围淋巴切除术虽然可以促进局部疾病控制,但并不能提升病人的生存期[6]。结合Reticker-Flynn团队的研究成果,不难发现,可能的解释是在手术切除淋巴结之前,肿瘤淋巴结转移造成的系统性免疫抑制已经建立,淋巴结切除术并不能逆转这一免疫抑制状态。
此外,这个研究还提醒我们,有效的免疫疗法还需要调动淋巴结中的T细胞免疫反应。因此,将淋巴结的免疫反应由抑制转为激活,可能才是晚期癌症病人治疗的有效策略。
来自:
更多阅读:
我们都知道运动有益健康,例如能提高免疫力、增强心肺功能、改善认知能力以及调节身体代谢水平等[1]。除了上述好处之外,急性运动测试之后,检测身体的各项指标,还可以发现一些隐匿在我们身上的疾病[2,3]。
不过,对于运动究竟是如何给人体带来这么些好处的这个问题,目前还没有人能从分子层面上把问题说清楚。
今天,由斯坦福大学医学院Michael P. Snyder和Francois Haddad领衔的研究团队,在顶级期刊《细胞》杂志发表重磅研究成果[4]。
他们从蛋白组学、代谢组学、脂质组学和转录组学层面,分析了志愿者在跑步机上运动(约8-12分钟)之前和之后近18000个分子的变化。
他们发现,在运动之后的1小时之内,近10000个涉及能量代谢、氧化应激、炎症、组织修复、生长因子反应,以及各种调节途径的分子,发生了剧烈的变化。对于已经出现胰岛素抵抗的人而言,他们在运动后免疫反应会受到抑制。此外,他们还发现了参与心肺运动反应的生物通路。
据了解,这也是科学家首次如此全面地分析运动在分子水平上对人体的影响。
▲ 该图片由TheOtherKev在Pixabay上发布
为了完成这项研究,研究人员招募了36名志愿者。这些志愿者年龄在40到75岁之间,BMI为28.4,其中58%是男性,有部分志愿者出现了胰岛素抵抗。
这些志愿者在经过一晚的禁食之后,在跑步机上完成运动心肺功能测试(CPX)[5](实际完成时间是6-18分钟)。Snyder团队会在志愿者运动之前,以及运动后的2分钟、15分钟、30分钟和60分钟的时间节点上,分别采集血样并保存。其中有14名志愿者在研究之后的第二天,又各自提供了一份血液,以作为空白对照。
采集完血样之后,研究人员就开始了紧锣密鼓地检测分析。他们对每个样本进行了深入的多组学分析,包括血浆的蛋白组学、代谢组学、脂质组学和外周血单个核细胞(PMBCs)的转录组学。
最终一共涉及17662个分子,其中包括15855个转录子,260个来自于非靶标分析的蛋白质,109个靶标蛋白质,728个代谢物和710个脂质。
▲ 实验设计流程
初步分析显示,运动让9815个分子的水平在运动前后发生了变化,而且这种变化与运动后的时间密切相关。
▲ 不同时间、不同组别分子的变化情况
紧接着,Snyder和他的同事又分析了运动在分子水平上对人体影响的个体性差异。他们发现,以靶标蛋白为参考,在基线时,差异最大的分别是脂质、代谢物、蛋白质和转录组,分别是62.0%、46.2%、38.9%和26.9%。运动之后,差异大小的顺序变成蛋白质、代谢物、转录组和脂质,分别是36.8%、32.1%、27.7%和17.0%。
▲ 运动影响个体间的差异
随后,Snyder团队先分析了运动对脂质、代谢物和蛋白质分子的影响情况。他们使用c-means聚类分析,将脂质、代谢物和蛋白质分子分成4个组群:第一个组群的分子在运动后增加,但是迅速恢复到基线水平;第二个组群的分子在运动停止一段时间后增加,然后恢复到基线水平;第三个组群的分子运动后下降,在1小时之内恢复到基线水平;第四个组群的分子在运动后持续减少。
此外,他们还划定了关键的生物过程,包括早期(能量代谢、氧化应激和免疫反应)和晚期事件(能量平衡、组织修复和重塑)。
将上面的两类信息一整合,就可以产生一个庞大的关系网,通过这个关系网,我们就可以一目了然地知道不同生物过程之间的关系,甚至能发现一些分子的新功能。
▲ 四个组群的基本情况
咱们先来看看第一个组群的分子。这个组群包含196个分子,主要涉及无氧代谢、免疫反应、氧化应激、脂肪酸氧化和复合脂质代谢。Snyder和他的同事认为,这个结果和他们预期的一样,糖酵解产物(乳酸、丙酮酸)和三羧酸(TCA)循环中间体(苹果酸)的血浆浓度急剧增加,这可能反映了厌氧代谢水平的提高。
在氧化应激方面,髓过氧化物酶(MPO)水平增加,它是中性粒细胞释放的,预示着骨骼肌损伤,会招募巨噬细胞到受损部位修复损伤。这大概就是运动能增强肌肉力量的原因所在吧。
免疫方面,促炎因子IL-6和肿瘤坏死因子α(TNF-α)的分泌增加。而TNF-α与多种细胞因子、单核细胞诱导蛋白1等的关联,证实它的促炎特性。
在脂肪酸氧化方面,酰基肉碱和游离脂肪酸水平的增加表明,脂肪酸氧化被运动激活。仅仅数分钟的运动,就能燃脂,何乐而不为啊。
▲ 第一组群分子组成的网络
第二个组群的分子有148个,它们是在运动之后一段时间增加,随后回到基线水平。这部分分子中的很大一部分与碳水化合物代谢有关。其中,脂肪酸结合蛋白3和4(FABP3和FABP4)的水平增加,它们会促进心脏组织和骨骼肌对葡萄糖和游离脂肪酸的吸收。
此外,研究人员还检测到凝血和止血因子的水平增加。如此看来,人体为了运动,真是做好了各种准备。
▲ 第二组群分子组成的网络
我们再来看看第三个组群的168个分子,它们先减少,然后在一小时内恢复到基线水平。在这个网络里,竟然是以瘦素和胃泌素这两种抑制饥饿感的代谢激素为中心。实际上,之前也有研究表明,运动之后这两种激素会降低。嗯,运动后真的会感觉到饿。
此外,运动之后体内谷氨酸、胱氨酸、色氨酸、丝氨酸、苏氨酸和甘氨酸这六种氨基酸水平也会降低,它们有可能被骨骼肌分解以产生能量。看来运动之后,要适当补充蛋白。
▲ 第三组群分子组成的网络
最后一组包括171个分子,它们持续减少,且没有恢复到基线水平。亮氨酸、异亮氨酸和缬氨酸等人体不能合成的支链氨基酸(BCAAs)是其中的一员。得补补~
▲ 第四组群分子组成的网络
以上就是脂质、代谢物和蛋白质分子的变化。接下来,我们再来看看外周血单个核细胞代表的免疫系统的变化。
很容易就发现,人体在运动之后,免疫系统是被强烈激活的,这与之前的研究基本一致。除了与免疫相关功能之外,促进细胞生长和迁移的分子也增加了,研究人员认为,这些分子可能参与了肌肉组织的修复和重塑。
还有许多与心血管和止血相关的信号途径也上调了,这突出了运动和心血管健康之间的相互联系。
▲ 运动对免疫能力的影响
最后,Snyder团队比较了运动对16名胰岛素抵抗志愿者和14名胰岛素敏感志愿者影响的差异。
在调整了各种混杂因素之后,有2279个分子的表现出现显著差异,其中1930个是外周血单个核细胞表达组的差异。
最终的结果是,胰岛素抵抗志愿者的免疫反应较弱,而且与修复相关的髓过氧化物酶增加也较弱。一些参与血管功能、对缺氧的反应和一氧化氮合成的一些心血管通路在胰岛素抵抗这体内受损。
还有就是胰岛素抵抗的人,运动后许多受运动影响的主要生物途径都发生了改变。例如,脂质、碳水化合物和氨基酸代谢,都比胰岛素敏感的人差;瘦素和胃泌素减少的水平也比胰岛素敏感者低。
对于胰岛素抵抗者而言,有个好消息是,胰岛素的反应确实是更强烈了。
▲ 胰岛素抵抗(IR)和胰岛素敏感(IS)之间的差异
总的来说,斯坦福大学医学院团队的这个研究提供了海量的数据,让我们对运动对人体的影响,有了更清晰的认知。其中海量的数据,还有待于研究人员进一步的挖掘。
来自:































