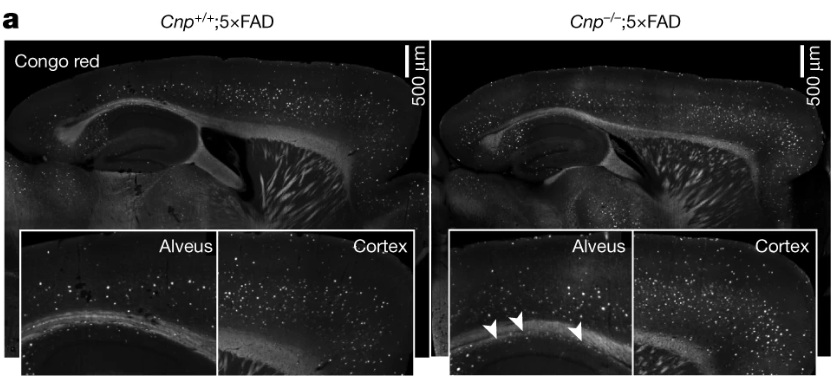
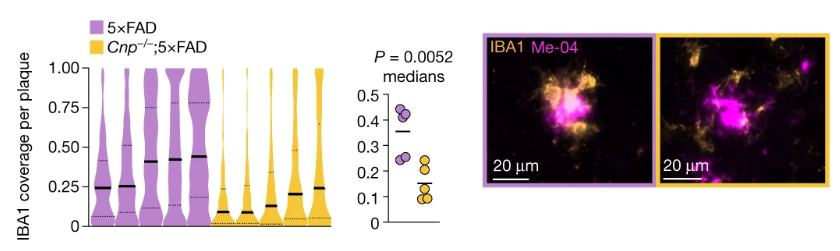
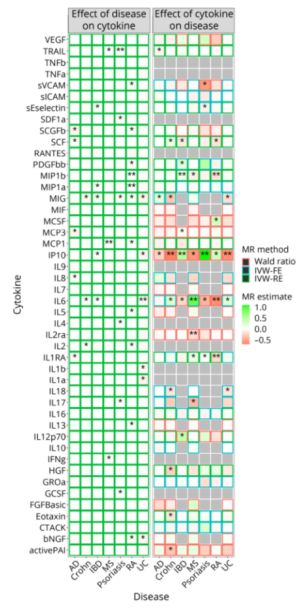
这项新研究的论文第一作者、哥本哈根大学医院的Pardis Zarifkar说道:“在COVID-19大流行开始两年多之后,COVID-19对神经系统疾病影响的确切性质和演变仍未确定。以往的研究已经确定了与神经系统综合症的关系,但直到现在还不知道COVID-19是否也影响特定神经系统疾病的发病率以及它是否与其他呼吸道感染不同。”
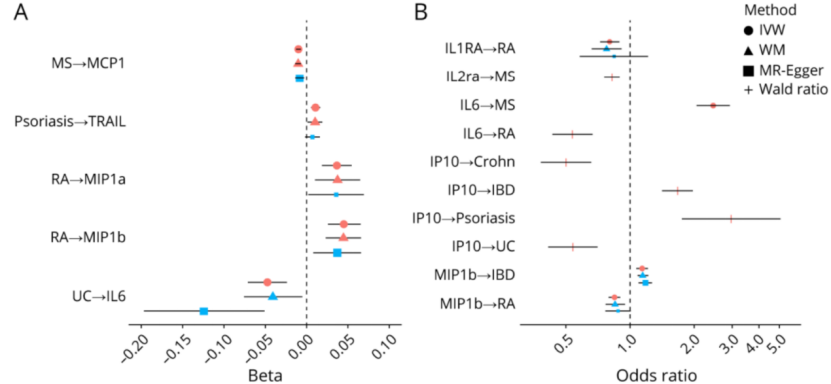
研究人员分析了丹麦总人口近一半的电子健康记录,时间跨度为2020年和2021年。在整个研究期间,那些COVID-19检测呈阳性的人被发现被诊断为阿尔茨海默病的可能性是3.5倍、被诊断为帕金森病的可能性是2.6倍、经历脑出血的可能性是4.8倍、发生缺血性中风的可能性是2.7倍。
Zarifkar注意到COVID-19之后这些神经系统疾病的风险增加确实反映了以前流感或细菌性肺炎病例之后的报告。然而由于COVID-19感染的普遍性,这些神经退行性疾病的基线率可能会在未来几年在世界各地上升。
“我们发现,跟COVID阴性患者相比,COVID-19阳性患者被诊断为神经退行性疾病和脑血管疾病的风险增加,这一点必须在不久的将来通过大型注册研究加以证实或反驳,”Zarifkar补充道,“令人欣慰的是,除了缺血性中风,大多数神经系统疾病在COVID-19之后似乎并不比流感或社区获得性细菌性肺炎之后更加频繁。”
几十年来,研究人员已经看到某些病毒感染和神经退行性疾病之间的相关性。也许最著名的是20世纪初西班牙流感大流行后帕金森病发病率的增加。
自2020年大流行开始以来,研究人员已经警告说帕金森病等疾病可能会激增,而这个新数据提供了这些预测可能会实现的早期信号。其他更多最近的研究已经开始挖掘到底是什么机制可能导致COVID-19之后神经退行性疾病的风险增加。
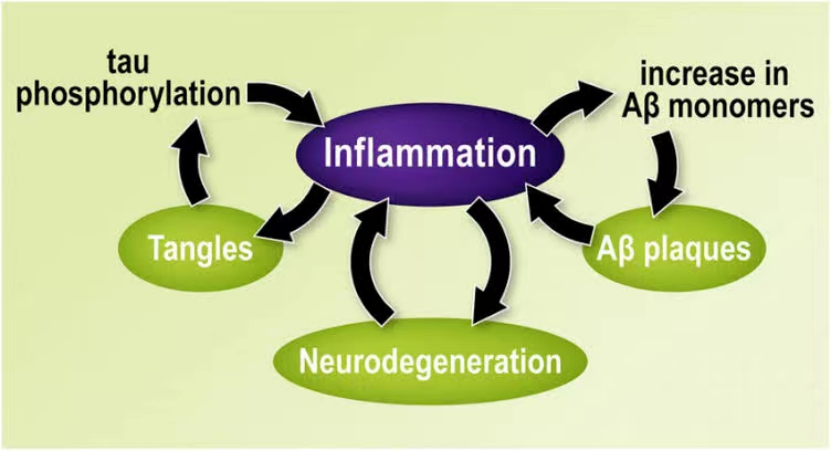
多年来,解释病毒感染和神经退行性疾病之间联系的最突出的假设是,由感染引发的炎症可能启动或加速神经系统疾病的发展。早在2012年发表的一篇评论文章表明,反复的病毒感染可能通过激活跟神经变性的早期阶段所见的一连串事件 增加了这种神经疾病的风险。
2012年的文章指出:“我们认为,神经退行性可以由反复的炎症反应引发然后随着时间的推移而传播。事实上,有证据表明,小胶质细胞和星形胶质细胞(大脑中的星形胶质细胞)的激活和反应都在追踪CNS(中枢神经系统)和PNS(外周神经系统)的现有神经元回路。这些炎症序列跟区域和细胞类型相关的神经元脆弱性相结合可能会造成特定的结构和功能的神经退行性模式,而这些模式定义了个别神经退行性疾病。”
最近的一些研究则发现了大脑炎症是一些COVID-19感染的特征。但目前仍不清楚该病毒可能如何导致这种神经炎症或这种自身免疫反应是否会造成长期问题。
英国阿尔茨海默病研究中心的Sara Imarsio在评论COVID-19的新发现时指出,重要的是要记住,导致痴呆的神经系统疾病是由一系列因素造成的–从遗传易感性到年龄和环境。因此,COVID-19在一个人发展这些疾病的总风险中可能只扮演一个小角色。
Imarsio还指出,其他一些因素可以解释感染了COVID-19的人患神经退行性疾病的比率更高的原因。而且要知道COVID-19对某些大脑疾病的长期影响当然还为时过早,因为这些疾病可能需要几十年的时间才能发展。
“像阿尔茨海默病这样的疾病在大脑中发展了很多年,而COVID-19自2020年初才出现在欧洲,可能是处于阿尔茨海默病非常早期阶段的人更容易染上像COVID-19这样的疾病。虽然这些发现的宣布有可能令人担忧,但我们需要在同行评议的出版物中看到这项研究的结果,然后才能从这项研究中得出任何真正的结论,”Imarsio补充道。